|
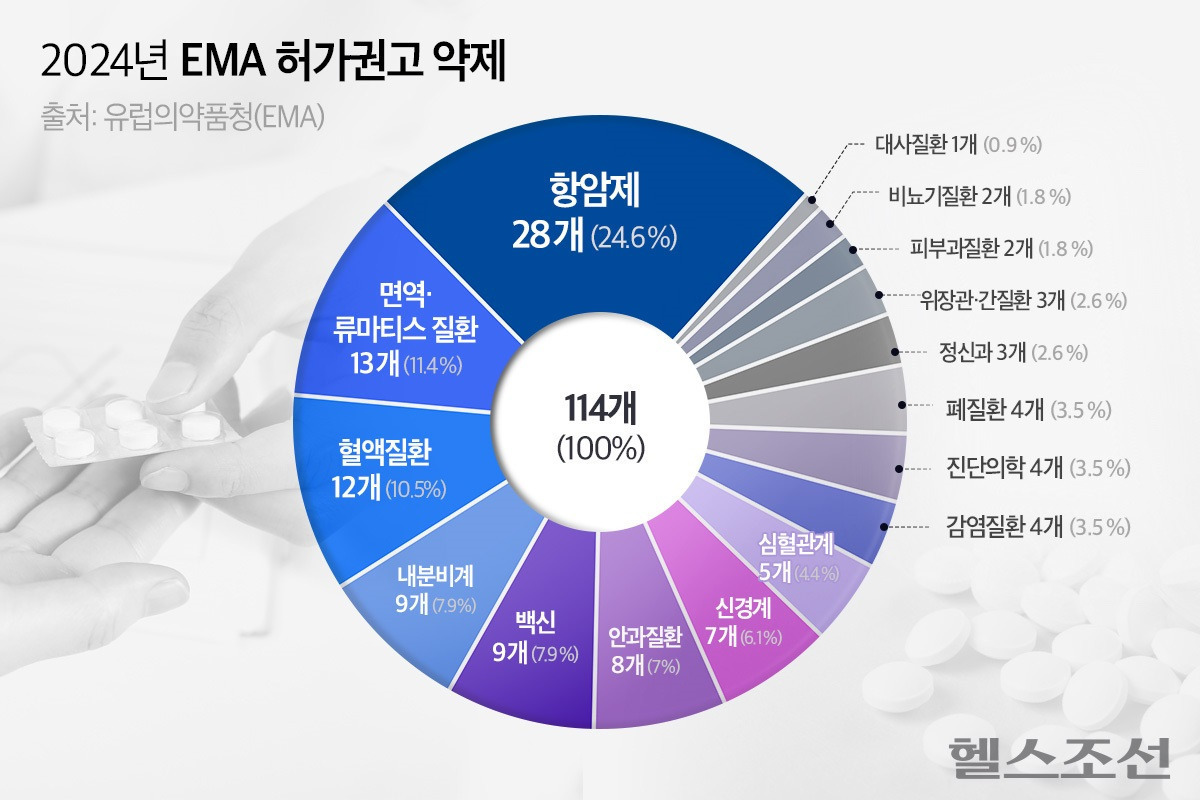
유럽의약품청(EMA)이 작년 한 해 동안 총 114개의 의약품에 대해 허가를 권고한 것으로 나타났다. 승인 권고된 약제를 살펴보면, 항암제가 24.6%로 가장 큰 비중을 차지했다. 여기에는 기존에 유럽에서 허가를 취득한 이력이 없는 새로운 물질 기반의 약제도 다수 포함된 것으로 나타났다. 또한, 오리지널 의약품 대비 저렴한 가격으로 환자들의 신약에 대한 접근성을 높일 수 있는 국내사들의 바이오시밀러(바이오의약품 복제약) 제품도 다수 허가 권고 의견을 받았다. ◇신규 활성 물질 기반 약제 다수… 레켐비·웰리렉 등 혁신 신약도 허가 권고 EMA는 '2024년 인체용 의약품’(Human medicines in 2024)' 보고서를 최근 발간했다. 지난해 EMA가 허가 신청을 접수한 의약품에 대해 제시한 의견을 유형별로 나눠보면, ▲승인 권고 의견 114건 ▲승인 거부 의견 5건 ▲보류 의견 8건으로 집계됐다. 이 중 46개는 이전까지 유럽에서 허가를 취득한 전례가 없는 새로운 활성 물질을 보유한 약제였다. 보고서에 따르면, 허가 권고가 이뤄진 114개의 의약품 가운데는 공공 보건 수요에 부응하거나 혁신성(기존에 없는 새로운 기전을 가진 특성)을 갖춘 치료제들이 많은 것으로 나타났다. 대표적인 예시로는 ▲에자이의 초기 알츠이이머병 치료제 '레켐비(성분명 레카네맙)'와 ▲ARS 파마슈티컬스의 아드레날린 비강 스프레이 '네피' ▲MSD의 폰 히펠-린다우병 관련 종양 치료제 '웰리렉(성분명 벨주티판)이 있으며, 특정 중증 감염증에 사용할 2개의 항생제 신약도 각각 허가 권고한 바 있다. 레켐비는 알츠하이머병의 주요 원인물질 중 하나인 아밀로이드 베타를 제거하는 새로운 기전의 치료제다. EMA는 레켐비에 대해 작년 7월 한 차례 승인 거부 의견을 낸 바 있으나, 지난해 11월 에자이의 재검토 요청을 수락하고 검토를 거친 끝에 기존 거부 의견을 번복했다. 네피는 알레르기 반응 치료를 위한 최초의 주삿바늘 없는 아드레날린 비강 스프레이로, 작년 6월 허가 권고됐다. 웰리렉은 작년 12월 국소 신세포암종, 중추신경계 혈관모세포종 또는 췌장 내분비종양 등의 치료를 필요로 하거나 국소수술이 부적합한 성인 폰 히펠-린다우병 환자들을 치료하기 위한 단독요법으로 허가 권고했다. 이외에도 EMA는 프랑스 제약사 발네바의 치쿤구니야열 백신 '익스치크'와 모더나의 60세 이상 호흡기 세포융합 바이러스(RSV)에 의한 하기도 감염증 예방용 mRNA 백신 '엠레스비아'의 허가를 권고하기도 했다. 또한, EMA는 바바리안 노르딕의 엠폭스 백신 '임바넥스(미국 제품명 진네오스)'의 경우 12~17세 연령대 청소년들로 접종 대상 확대를 권고했다고 밝혔다. ◇항암제, 28건으로 최다… 국내사 바이오시밀러도 다수 포함 보고서에 따르면, 2024년 허가 권고 최다건수를 기록한 치료제는 항암제로, 114건 중 28건를 차지했다. 그 뒤를 면역·류마티스 질환(13개)과 혈액질환 치료제(12건)가 이었으며, 내분비계 치료제와 백신(9건), 안과(8건), 신경계 질환(7건)도 각각 5% 이상의 비중을 차지했다. 이외에는 ▲심혈관 질환 ▲감염질환 ▲진단의학 ▲폐질환 ▲정신과 질환 ▲위장관·간질환 치료제 등이 EMA의 승인 권고를 거쳤다. 새로운 바이오시밀러(바이오의약품 복제약)에 대해서도 28건의 허가 권고가 이뤄졌다. 여기에는 항암제뿐만 아니라 골다공증, 황반변성, 판상형 건선, 염증성 장질환(궤양성 대장염·크론병) 등 비정상적인 면역 반응 관련 치료제들의 복제약들이 다수 포함됐다. 삼성바이오에피스(오퓨비즈, 피즈치바, 오보덴스, 엑스브릭 등), 셀트리온(옴리클로, 스테키마, 스토보클로, 아이덴젤트, 앱토즈마 등), 동아에스티(이뮬도사 등) 국내 제약·바이오사의 바이오시밀러도 허가 권고를 받았다. 이외에도 희귀의약품 지정 15건, 첨단 치료 의약품 지정 1건, 제네릭 17건, 신속심사 3건, 조건부 승인 8건 등에 대해 긍정적인 의견을 제시한 것으로 집계됐다. EMA는 "이번 보고서에는 의약품 승인에 대한 통계와, 치료 영역에서의 상당한 발전을 의미하는 새로운 치료제가 다수 포함됐다"며 "특히 바이오시밀러의 허가 권고는 잠재적으로 환자들의 삶을 바꿀 수 있는 의약품에 대한 접근성을 높이기 때문에 환자들에게 좋은 소식이 된다"고 밝혔다. 출처 : https://health.chosun.com/site/data/html_dir/2025/01/21/2025012102350.html |
출처: 크리에이터 정관진 제1군단 원문보기 글쓴이: 니르바나
'병원 치료 > 항암' 카테고리의 다른 글
| 스크랩 작년 식약처 지정 신약 26개… 80%는 글로벌 제약사 제품 (0) | 2025.02.09 |
|---|---|
| 스크랩 셀트리온, ADC 항암제 개발 본격화… 美FDA에 임상 계획서 제출 (0) | 2025.02.06 |
| 스크랩 ADC부터 유전자치료제까지… 전이·내성 극복할 항암 신약 나올까 (0) | 2025.01.30 |
| 스크랩 J&J, 지난해 매출 127.6조… 항암제 업고 ‘훨훨’ (0) | 2025.01.28 |
| 스크랩 루마크라스·칼퀀스… 美서 항암제 적응증 확장에 열 올리는 글로벌 [팜NOW] (0) | 2025.01.24 |



