|
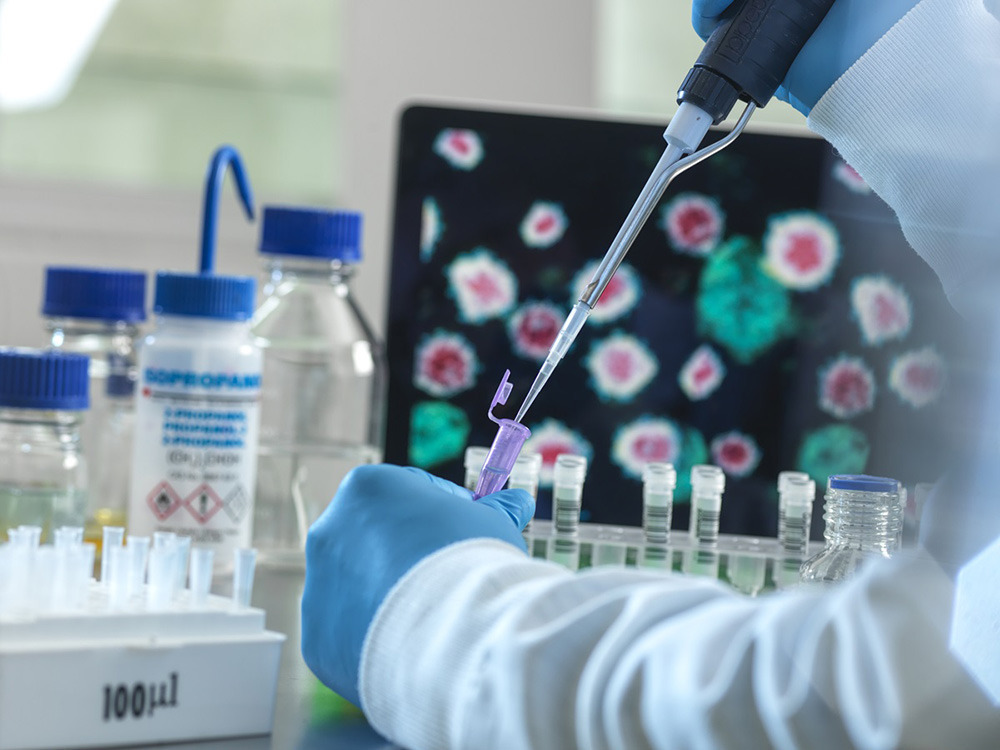
올해부터 ▲수입 원료의약품 등록 절차 완화 ▲의약품 허가·GMP(우수 의약품 제조·품질관리 기준) 적합 판정에 필요한 제출자료 통합·조정 ▲신약 허가심사 수수료 인상을 비롯한 의약품 관련 제도가 실시된다. 식품의약품안전처에 따르면, 오늘부터 신약 허가·심사 혁신 방안(프로세스)이 시행된다. 신약 허가 신청이 접수되면 품목별로 전담팀을 구성하고, 회사와 허가 심사자의 대면상담·심사를 기존 최대 3회에서 최대 10여회로 확대해 그 결과를 문서로 안내한다. 신약 제조소에 대한 GMP 평가와 실태조사는 허가 접수 후 90일 이내에 실시된다. 이를 뒷받침하기 위해 수익자 부담 원칙에 따라 재산정된 4억1000만원의 신약 허가 신청 수수료가 내년 신청 건부터 적용된다. 식약처는 "신약 허가 신청부터 허가증 발급까지 295일 이내에 완료될 수 있도록 전문성 기반의 신속·투명·예측 가능한 허가심사 시스템을 운영한다"며 "이를 통해 신약의 신속한 제품화를 지원할 것으로 기대한다"고 했다. 의약품 허가·등록을 위한 GMP 평가도 개편된다. 식약처는 수입 원료의약품 등록(DMF) 시 GMP 적합 평가를 'WHO/PICS GMP 기준에 적합함을 입증하는 GMP 증명서' 확인으로 대체하고, 처리 기간을 120일에서 20일로 대폭 단축한다. 의약품 허가 신청 시 GMP 평가에 필요한 제출자료는 기존 11종에서 4종으로 통합·조정한다. 또한, 위험도가 낮은 의약품 제조소 GMP 정기조사는 서면조사로 실시한다. 의약품 제조소가 GMP 적합판정을 받은 후 3년 주기로 정기조사를 받을 때 원칙적으로는 현장조사를 받아야 했으나, 제조소에 대한 사전 평가 결과에 따라 중대한 변경이력이 없는 등 위험도가 낮은 경우에는 현장 조사를 받지 않고 서면조사를 통해 GMP 적합판정을 2년 연장할 수 있도록 제도가 개선된다. 2년 연장 후에는 현장조사를 실시한다. 식약처는 현장조사 이외 서면조사 등 운영에 대한 구체적인 방안을 마련해 내년 상반기 중에 업계 설명회를 진행하고, 하반기부터 시행할 계획이라고 밝혔다. 현장조사를 통한 GMP 적합판정서 연장 시에는 그 유효기간 산정기준을 기존 ‘실사 종료일로부터 3년’에서 '기존 유효기간 만료일 다음날로부터 3년'으로 개정해 유효기간 3년을 온전히 보장받을 수 있게 한다고도 전했다. 출처 : https://health.chosun.com/site/data/html_dir/2024/12/31/2024123100939.html |
출처: 크리에이터 정관진 제1군단 원문보기 글쓴이: 니르바나
'공지사항' 카테고리의 다른 글
| 스크랩 젤리 먹다가 기도 막힌 美 남아, 명동역 직원들이 ‘이렇게’ 살렸다 (0) | 2025.01.05 |
|---|---|
| 스크랩 “연예계 비상, 공연 줄줄이 취소” 이승철 이어 윤도현도?… ‘이 바이러스’ 감염 심각 (0) | 2025.01.05 |
| 스크랩 가격 그대로지만 용량은 줄이는 '꼼수', 이젠 안 된다 (0) | 2025.01.03 |
| 스크랩 우리 동네 고혈압·당뇨병 1등급 병원 찾는 방법 (0) | 2025.01.03 |
| 스크랩 ‘콜록콜록’ 8주 지속되면 만성 기침… 의심해봐야 할 질환은? (0) | 2025.01.02 |



